
Las cinco mejores recomendaciones para ahorrar tiempo y prevenir complicaciones al empezar una PCR real time
1. ADN de alta calidad
Asegúrate de que la integridad y la pureza de tu ADN son suficientes para la técnica de PCR real time. ¿Cómo? Con un protocolo de extracción de ADN adecuado y haciendo chequeos. Analiza en espectrofotómetro la relación 280/260.
A María le pasó: usaba el mismo kit de extracción de ADN que “siempre se había usado en su laboratorio” y durante 6 meses sus resultados de expresión relativa no tenían sentido, no había ningún patrón, cambió primers, sondas, temperaturas… pero no solucionaba nada. Entonces llegó a su laboratorio Sergio y le sugirió que analizara su ADN… ¡el método de extracción que usaba daba unos ratios 260/280 de menos de 1,6! La solución fue sencilla: compraron un nuevo kit de extracción de ADN específico para los tejidos con los que trabajaba María, comprobaron que la calidad de su ADN extraído era buena y todo empezó a tener sentido.
2. Cantidad óptima de ADN
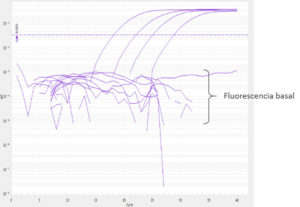
Tu ADN debe amplificar entre los ciclos 15 y 35. Si tras las primeras carreras ves que las curvas de amplificación son antes del ciclo 15, diluye tu muestra y vuelve a hacer la amplificación; obtendrás mediciones más precisas.
3. ¿Nueva diana, nuevo experimento? Optimízalo antes de empezar
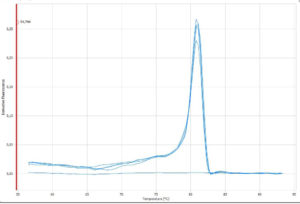
Cada nueva pareja de primers, cada nueva sonda merece una nueva validación. Comprueba eficiencia y especificidad. Siempre será mejor tomarse el tiempo necesario para hacer esto, que tener que invalidar un estudio completo por no haber optimizado las condiciones del ensayo.
A Sergio le pasó: esta vez fue Sergio el que, por las prisas, tuvo que repetir todo un ensayo. Él siempre había trabajado con SYBRgreen y en las mismas condiciones, las que le habían dado. Pero tenía un nuevo gen que analizar y diseñó los primers e hizo los experimentos igual que hacía todos los demás… al presentar los resultados para publicar, primera cuestión le pidieron la validación de esos primers y la comprobación de que estaban optimizados. Al comprobarlo, ¡horror!, los primers no eran específicos; los resultados no eran fiables. La solución esta vez no fue sencilla: hubo que diseñar nuevos primers, validarlos y entonces sí, realizar el ensayo de nuevo.
4. Evita la contaminación ¡No te confíes!
La PCR es una técnica extremadamente sensible, y los ácidos nucleicos están “por todas partes”. Para evitar contaminación, separa bien las zonas pre- y post-PCR y dentro de la zona pre-PCR separa las zonas “libres de ADN” y las zonas “con ADN”. Extrema la limpieza y utiliza productos que eliminen el ADN.
5. Cumple con los estándares de calidad
Calibra las pipetas y los equipos regularmente. Para que los resultados sean fiables recuerda que las desviaciones en el pipeteo deberán ser mínimas y estar dentro del umbral establecido (la desviación estándar de los Ct de las réplicas técnicas habrá de ser menor a 0,3). No dejes pasar ninguna muestra que no pase los estándares de calidad, los resultados no serían fiables.
Y si vas a publicar…
Ten en cuenta que existen ciertas reglas para publicar este tipo de resultados. Stephen Bustin y colaboradores han recopilado una lista de requerimientos mínimos para publicar experimentos de PCR real time, conocida como directrices MIQE (the MIQE guidelines), que es recomendable consultar si tienes la intención de publicar tus resultados.
Ana Belén Saccone García, responsable del curso práctico PCR Tiempo Real de On Science
